导读⭐
Introduction
缺氧诱导因子(hypoxia inducible factor, HIF)是响应细胞环境中缺氧的转录因子,在正常氧含量的环境下会被脯氨酸羟化酶迅速羟基化。羟基化的HIF蛋白会被E3泛素连接酶复合物识别并泛素化,进而通过蛋白酶体降解。低氧环境下,稳定的HIF会激活下游基因的表达,从而增强红细胞生成、血管生成、能量代谢等生理过程,提高对低氧环境的适应性。HIF与胚胎发育、肿瘤的发展和转移等多种生理病理过程息息相关,同时,为了适应缺氧环境,多种高原生物在进化过程中获得了增加HIF稳定性或表达量的突变。
2022年,张二荃实验室在高原鼠兔(Ochotona curzoniae)的Epas1(Hif2a)基因中发现了一个物种特异性的突变,该突变导致Epas1的转录本在第14和15个外显子之间增加了72个碱基,从而使其翻译产物增加了24个氨基酸,该插入片段提高了蛋白质的稳定性,扰乱了高原鼠兔的昼夜节律并提高了高原鼠兔对低氧环境的耐受性(Liu et al., Cell Rep, 2022)。然而,该段插入序列导致Epas1稳定性增加的机制并不清楚。
2024年9月12日,清华大学生物医学交叉研究院/北京生命科学研究所张二荃实验室在Cell Reports在线发表了题为"A nature-inspired HIF stabilizer derived from a highland-adaptation insertion of plateau pika Epas1 protein"的研究论文。该项研究揭示了高原鼠兔缺氧诱导因子Epas1蛋白稳定性增加的生化机制,并以其24个氨基酸的插入片段为灵感,开发设计了潜在的具有缺氧诱导因子稳定作用的多肽。
在先前的研究中,研究人员发现将这24个氨基酸的片段插入到家兔、大鼠、小鼠的Epas1蛋白的对应位置(下称L-Epas1,不具该插入片段的蛋白称为S-Epas1),均可提高其蛋白稳定性,这说明该插入片段对提高Epas1稳定性来说是充分的(Liu et al., Cell Rep, 2022)。为探究其提高蛋白稳定性的机制,研究人员对L-Epas1和S-Epas1的羟基化、泛素化过程,以及与脯氨酸羟化酶PHD2和E3泛素连接酶pVHL的相互作用进行了检测。结果显示,L-Epas1的泛素化程度显著低于S-Epas1,但意外的是,L-Epas1与pVHL的相互作用却比S-Epas1更强。
为探究L-Epas1与pVHL相互作用变强,但泛素化反而减弱的原因,研究人员对pVHL进行了突变和截短,发现除氧依赖性降解结构域(oxygen-dependent degradation domain,ODD)与pVHL的β结构域的识别作用外,24个氨基酸的插入片段还会与pVHL的C端α结构域产生额外的相互作用,从而增强了L-Epas1与pVHL的互作。
这24个氨基酸的插入片段位于Epas1蛋白C端的无序区域(intrinsic disordered region, IDR),虽然总体上是无序的结构,但在与其他蛋白产生相互作用时,或位于特定环境中,IDR的部分区域也会产生二级结构并发挥重要的生理功能(Holehouse et al., Nat Rev Mol Cell Biol, 2023)。AlphaFold对该插入片段与pVHL的建模显示,这24个氨基酸的后半段(P14-D24,称为E14-24)会在与pVHL互作时形成α螺旋,并占据延伸蛋白C(elongin C, ELOC)与pVHL的互作位点,进而阻止E3泛素连接酶复合物的形成。对L-Epas1与pVHL预测的相互作用位点分别进行突变,也验证了计算预测的模型。另外,研究人员合成了插入片段及其不同截短体的多肽,发现在免疫共沉淀的体系中加入多肽E14-24或其他包含这段序列的截短体,可以不同程度地阻止pVHL和ELOC的结合。研究人员通过生物素标记的多肽片段的pull down实验进一步证明了多肽E14-24可以与pVHL C端的α结构域产生特异性的相互作用。
一般来讲,细胞膜对多肽的通透性并不高,因为肽键会与水分子形成氢键,从而阻止其进入细胞膜内。然而,对于可以形成α螺旋的肽段来说,分子内的肽键会被用于维持α螺旋的结构,因此其跨膜性能大大提升。研究中也有利用α螺旋结构的多肽开发蛋白-蛋白/蛋白-DNA相互作用抑制剂的先例(Tokareva et al., Nat Commun, 2023),因此研究人员认为E14-24也具有作为缺氧诱导因子稳定剂的应用潜力。在多肽E14-24上连接了荧光基团FITC作为标记,发现该多肽具有较好的膜通透性。使用多肽E14-24处理细胞,可以有效增加细胞内源性的HIF-1α和EPAS1的蛋白稳定性,其效果与同等浓度或稍低浓度的脯氨酸羟化酶抑制剂罗沙司他(FG-4592)相当。在多肽处理后,VEGFA、EGFR等包含缺氧响应元件(hypoxia responsive element, HRE)的基因表达水平也均有一定程度的升高。
将小鼠放入10%氧气的环境中进行急性低氧处理三天后,小鼠的体重会急剧降低,而后会随着对低氧环境的适应,有部分的体重回升。在急性低氧处理后,隔天对小鼠进行多肽E14-24的注射给药,可以有效加速小鼠体重的回升,这意味着多肽可能加速了小鼠对缺氧环境的适应。同时,在给药10天后(即5次给药后),在小鼠的心肌组织中可以检测到HRE基因的表达水平升高。
综上,本研究揭示了高原鼠兔Epas1物种特异性的插入片段会通过阻碍pVHL-ELOC的相互作用,干扰E3泛素连接酶复合物的形成,从而减弱了泛素化、增加了蛋白稳定性(图1)。又以这段24个氨基酸的插入片段为基础,合成了多肽E14-24,验证了该多肽具有较好的跨膜性能,并可以在细胞中和体内有效增加HIF-α的蛋白稳定性,诱导HRE基因表达。本研究阐明了高原鼠兔低氧适应性提高的分子机制,为IDR的重要生理功能提供了新的证据,也为开发以自然为灵感的缺氧诱导因子多肽稳定剂提供了新的可能。
清华大学生物医学交叉研究院/北京生命科学研究所张二荃实验室的博士生虞子青为本文的第一作者,张二荃博士和虞子青为共同通讯作者。其他作者还包括张二荃实验室的冉光地和柴娟。本课题的研究经费受清华大学、中国科技部、国家自然科学基金委和北京市政府支持。
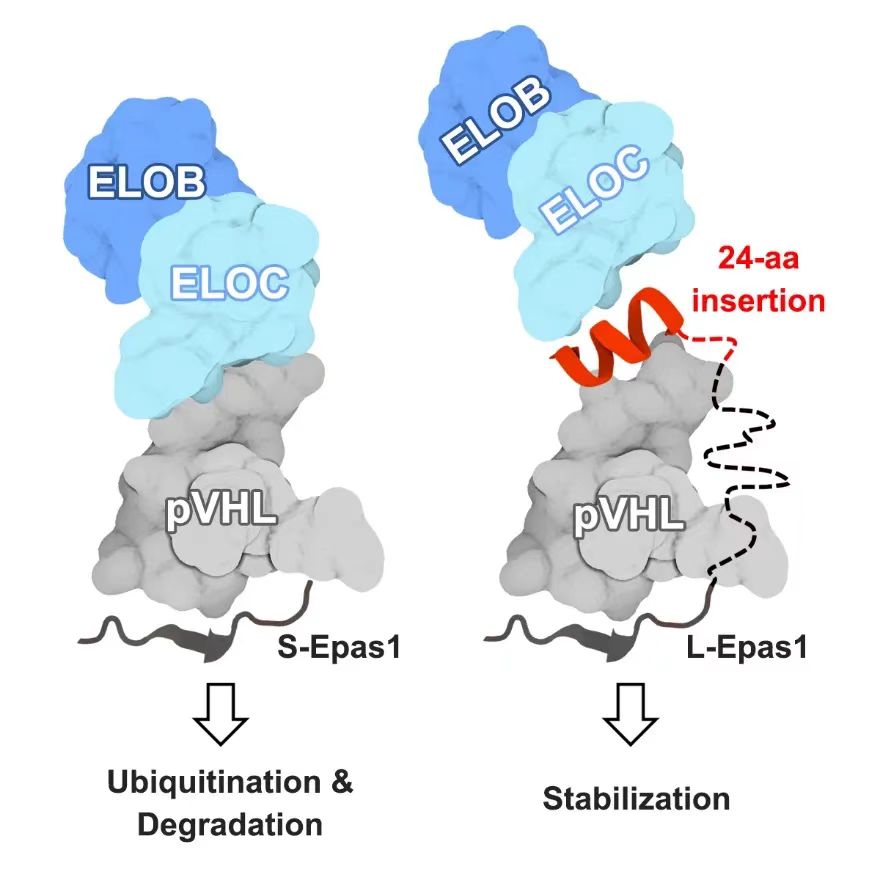
图1 L-Epas1的插入片段阻碍pVHL与ELOC相互作用的示意图
参考文献
1. Liu N, Tian H, Yu Z, et al. A highland-adaptation mutation of the Epas1 protein increases its stability and disrupts the circadian clock in the plateau pika. Cell Rep. 2022 May 17;39(7):110816.
2. Holehouse AS, Kragelund BB. The molecular basis for cellular function of intrinsically disordered protein regions. Nat Rev Mol Cell Biol. 2024 Mar;25(3):187-211.
3. Tokareva OS, Li K, Travaline TL, Thomson TM, et al. Recognition and reprogramming of E3 ubiquitin ligase surfaces by α-helical peptides. Nat Commun. 2023 Nov 1;14(1):6992.
论文链接
https://doi.org/10.1016/j.celrep.2024.114727